Una de las técnicas de sincrotrón más conocidas es la difracción de rayos X (DRX), que se aprovecha en laboratorios convencionales desde principios de siglo XX. Cuando los rayos X inciden sobre un cristal se reflejan en la red tridimensional ordenada de los planos de átomos, se difractan y dispersan de acuerdo con su estructura y se registran en uno o más detectores. A partir de los patrones de difracción lineal, bi- o tridimensional que forman los rayos X reflejados, se pueden deducir por ello la estructura cristalina y muchas características de la muestra. La difracción se emplea en el estudio de materiales naturales y compuestos químicos, como minerales, cerámicas, muestras biológicas y materiales electrónicos y magnéticos. Esta es, por ejemplo, una técnica absolutamente indispensable hoy para determinar la estructura de las proteínas y otras complejas moléculas determinantes en los procesos vitales, como la estructura y composición de los virus. La dispersión proporciona información sobre la estructura y dinámica de grandes moléculas que muestran menos orden, características de las células vegetales y animales, polímeros y coloides.
Un ejemplo de empleo de la DRX se presenta en la figura 2. Se estudió en la línea de luz MCX del sincrotrón Elettra (Trieste, Italia) una muestra en polvo del material Li0.5Zn1.67Sb0.83O4, que tiene propiedades de “baristor” (que se emplea en circuitos de seguridad eléctrica) [1]. El gráfico presenta el gráfico del “difractograma” de los ángulos a los que ocurren las reflexiones de los rayos X y sus intensidades. También se presenta una representación de la red tridimensional de planos, tetraedros y octaedros que forman los átomos del compuesto, que se obtiene de interpretar el difractograma.

Figura 2: Patrones de difracción de rayos X observado y calculado de Li0.5Zn1.67Sb0.83O4 y estructura cristalina deducida del patrón [1].
Los materiales biológicos forman patrones y estructuras mucho más complejas. Una dificultad intrínseca de la medición de estructuras biológicas es que están formadas por átomos muy ligeros, cuyas reflexiones son de baja intensidad. La luz sincrotrón ha servido para reducir los tiempos de estudio de estos materiales. Por ejemplo, los difractogramas de macromoléculas biológicas en la época de su descubrimiento en el siglo XX podían tardar un año en ser colectados. Actualmente en los sincrotrones esos patrones se obtienen en fracciones de segundos. Dos ejemplos del empleo de la DRX en materiales biológicos se presentan a continuación.
En un estudio de la capacidad de biosíntesis de varios tipos de Cándida en ambientes de elementos tóxicos se estableció, mediante la difracción de rayos X de polvos en sincrotrón, que este patógeno es capaz de sintetizar microcristales de sulfuros de plomo, cadmio y mercurio dentro y fuera de la célula [2]. Este mecanismo le permite a la célula adaptarse y supervivir en diferentes hábitats fisiológicos y ambientales. En la figura 3 se muestran las imágenes de microscopio electrónico de barrido del experimento, acompañada de los patrones de DRX. Este estudio también se realizó en el sincrotrón Elettra.

Figura 3. Muestras de Candida sometidas a ambientes tóxicos [2]. Columna izquierda: mapa de las intensidades de las concentraciones de plomo (arriba) y mercurio (abajo) de espectroscopía elemental en microscopio electrónico de barrido. Columna derecha: Patrones de DRX de las diferentes muestras de Cándida, donde de los picos afilados se puede interpretar la presencia de sulfuros de plomo (arriba) y de mercurio (abajo).
Cuando se trata de descifrar la estructura de las proteínas los patrones son mucho más complejos, como es el caso del primer estudio a nivel mundial de la proteína intra-mineral Ovocleidin-17 (OC17), extraída de los cascarones de huevo [3]. La estructura es tan compleja que produce ¡más de 26 mil reflexiones! En esos casos, los científicos presentan figuras tridimensionales donde se representan las superficies electrónicas y detalles de algunas partes de las moléculas. La figura 4 presenta uno de los diagramas de la estructura de la OC17, reportados en [3]. Este estudio se realizó en la línea de luz BM14S de la Instalación Europea de Radiación Sincrotrón (European Synchrotron Radiation Facility, ESRF, Grenoble, Francia).
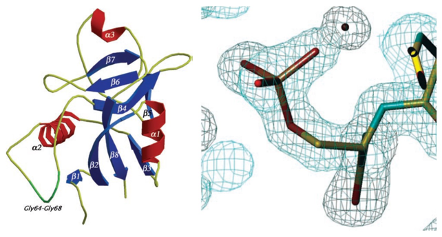
Figura 4. Izquierda: Arquitectura general de Ovocleidin-17 (OC17). La topología es la de una estructura mixta a/b, que se compone de tres hélices a más ocho hebras b [3]. Derecha: Segmentos de la densidad electrónica de la proteína OC17.
 SOCIEDAD MEXICANA DE LUZ SINCROTRÓN A.C.
SOCIEDAD MEXICANA DE LUZ SINCROTRÓN A.C.